Этилен из этана можно получить дегидрированием:
СН3-СН3 -----> СН2=СН2 + Н2.
Самое смешное, что я сам бывший химик, но конкретных условий проведения такой реакции не знаю. Ведь различных химических реакций и процессов - миллионы, и реально химики хорошо знают только ту область, в которой работают. На практике (в лабораторной практике или в промышленности) такой процесс не проводится. Наверное нужно нагревание, градусов этак до 500 (Цельсия) и использование каких-либо катализаторов (металлов наподобие меди, никеля, платины, палладия).
Этан из этилена получают по обратной реакции, называется гидрирование.
СН2=СН2 + Н2 -----> СН3-СН3.
Условия проведения примерно те же, что и для дегидрирования, разве что отличается тем, что гидрирование проводится под избыточным давлением водорода, возможно даже достаточно большим.
В 1827 году 1827 г. датскому химику и фармацевту Вильяму Цейзе понадобилось получить тетрахлороплатинат калия K2[PtCl4]. Эту соль получают из хлорида калия и платинохлористоводородной кислоты H2[PtCl4]. Цейзе знал, что продукт реакции хорошо растворяется в воде и плохо в этиловом спирте. Потому для полноты осаждения продукта он решил провести синтез не в водном растворе, а в спиртом. Однако, прилив к спиртовому раствору кислоты он добавил водный раствор хлорида калия, то вместо ожидаемого красно-коричневого осадка выпал осадок желтого цвета. Его анализ показал, что это не известное ранее вещество, которое имеет необычный состав: KCl∙PtCl2∙C2H4∙H2O, то есть неорганическое соединение содержит молекулу этилена! Было понятно, что этилен получился из спирта, но механизм этой реакции и строение желтого вещества были выяснены только спустя сто лет. Было показано, что образуется комплексная соль, в которой молекула этилена координационно связана с атомов платины. А уравнение реакции такое:
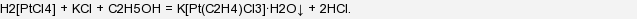
Автор утверждает, что "Уксусная кислота вступает в реакцию с углекислым газом". Уксусная кислота не реагирует с углекислым газом! Иначе в открытой склянке с уксусом уксуса бы не осталось - кислота в нем прореагировала бы с углекислым газом из воздуха. Аналогично пировиноградная кислота тоже не реагирует с углекислым газом! Неверно также, что "лимонная кислота спонтанно распадается на две более мелкие молекулы". Лимонная кислота - вполне устойчивое химическое соединение, она может храниться исключительно долго и вовсе не распадается на "более мелкие молекулы", тем более - спонтанно. Возможно, автор что-то слышал о цикле Кребса (цикле трикарбоновых кислот), но неправильно понял "услышанное".
Дополнение к ответу. Оказывается, такой синтез был проведен на 20 лет раньше, в 1982 году. Статья была опубликована в Журнале Американского химического общества? 1982, том 104, стр. 3219, авторы - сотрудники химического факультета университета штата Колорадо D.M.Walba, R.M.Richards и R.C.Haltiwanger. Исходным веществом послужила молекула в виде длинной плоской ленты (с названием трис(тетрагидроксиметилен)диолди(пара-толуол)сульфонат), концы которой могли "склеиваться". При этом получались кольцевые молекулы двух типов: когда "склеивание" концов происходило без перекручивания ленты и когда лента случайно перекручивалась.
Для производства аммиака необходимо два компонента: азот и водород. Азот выгодно брать из воздуха, так как его содержание в нем около 78 % и этот состав постоянен. Водород для данного процесса получают из природного газа при сжигании: СН4 + 0,5О2 = 2Н2 + СО. Полученный таким способом водород всегда содержит в своем составе примеси. Для его очистки применяют различные поглотители, которые могут быть как жидкими, так и твердыми. Основное уравнение синтеза аммиака: N2 + 3H2 = 2NH3