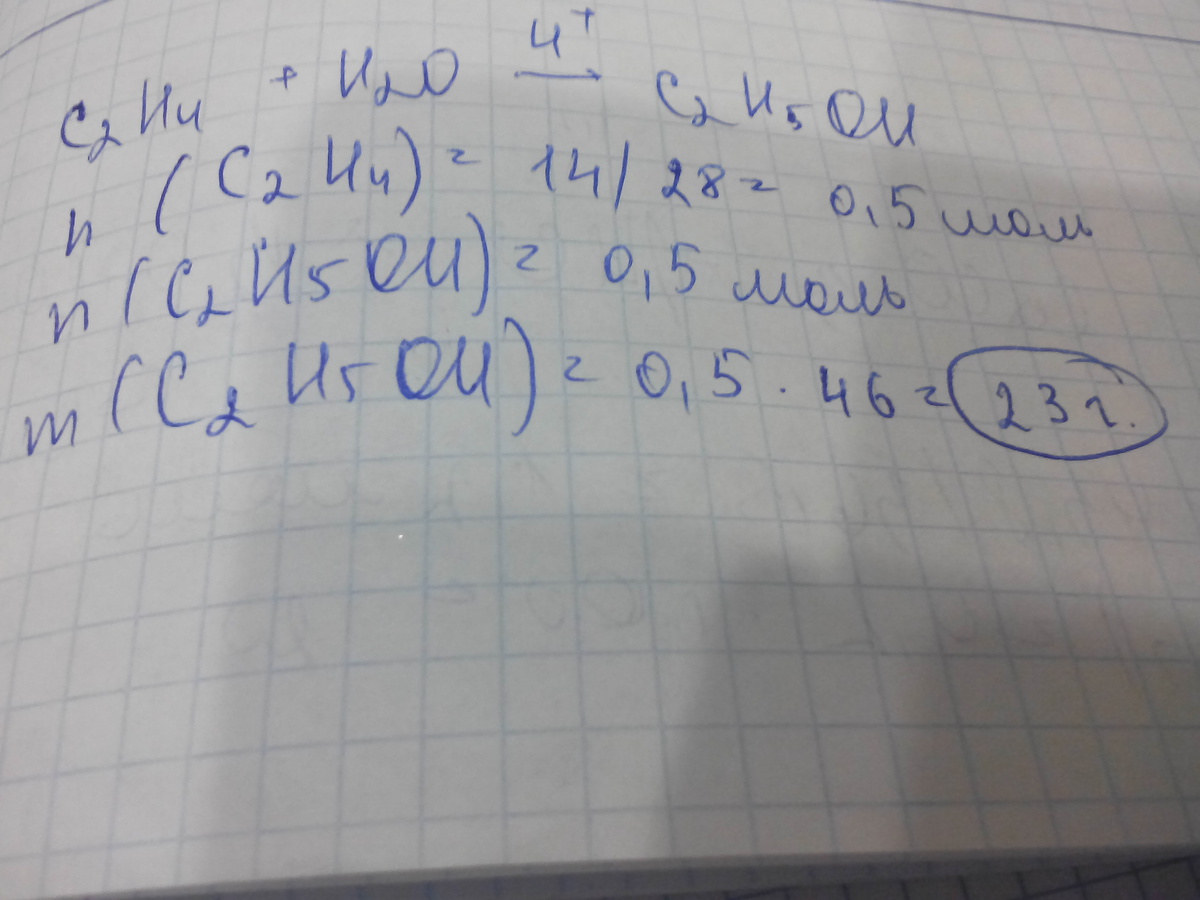Близько 1671 англійський хімік і фізик Роберт Бойль (1627-1691) вперше отримав водень (H2), розчиняючи залізні голки в сірчаної кислоти (H2SO4); проте його хімічну природу він пояснити не зумів. У 1766 році англійським фізик і хімік Генрі Кавендіш (1731-1810) довів у своїй роботі з експериментального дослідження повітря, що в ньому є газ, що різко відрізняється від повітря, і повідомляє про відкриття водню і вуглекислого газу (CO2). Діючи соляною кислотою (HCl) на цинк (Zn) і залізо (Fe), він виявив невідомий безбарвний газ, не має запаху і смаку.
Виявилося, що газ горить, вибухаючи, тому він був названий "горючим повітрям". У 1784 році Генрі Кавендіш, пропускаючи через суміш пального повітря і кисню електричну іскру, виявив, що в посудині з'явилася вода. Після низки точних дослідів, він переконався, що продуктом горіння була тільки вода, яка не мала запаху або смаку і при випаровуванні не залишала залишку. Таким чином, Генрі Кавендіш визначив хімічний склад води (H2O). До таких же висновків прийшов трохи пізніше французький хімік Антуан Лоран Лавуазьє (1743-1794). Латинське (Hydogenium) і російське назви походять від грецького hydro genes - породжує воду.
2. Становище в таблиці Менделєєва
Водень є першим хімічним елементом в періодичній системі. Його атом складається всього з двох елементарним частинок: протона, що є ядром і кайносімметрічного електрона обертового по s-електронної орбіталі, тому позитивний іон водню має найменші розміри (в 10000 разів менше) порівняно з атомом і володіє сильним поляризующим дією. Для атома водню застосовна квантова теорія Бора і рівняння Шредінгера для нього має точне рішення.
Водень займає особливе положення в періодичній системі і може бути віднесений, як до I, так і до VII головній підгрупі. Як лужний метал проявляє в з'єднаннях ступінь окислення +1, має яскраво виражені відновні властивості, для нього характерні реакції взаємного витіснення. Спектр водню подібний зі спектрами лужних металів. Але при цьому, як галоген може приєднувати електрон з утворенням іона водню H-, йому бракує одного електрона на зовнішньому енергетичному рівні, як і легкі галогени, він є газоподібним речовиною, його молекула складається з двох атомів, у з'єднаннях заміщається галогенами, потенціал іонізації порівняємо з представниками VII головної підгрупи (H-13,6 еВ, F- 17,4 еВ, а Li-5,6). Однак у атома водню відсутня ефект екранізування, на відміну від лужних металів, молекулярні орбіталі відрізняються від галогенів, тому можна розташувати водень цілком над другим періодом від літію до фтору.Спостерігаються відмінності між багатьма властивостями ізотопів водню, але внаслідок їх низького вмісту похибка вимірювань не велика. Найбільші відмінності спостерігається у термодинамічних величин, внаслідок відмінності частот коливань атомів викликаного відмінністю ізотопних мас. Швидкість звуку при t = 0 С в середовищі протію - 1284 м / с більше, ніж в середовищі дейтерію - 890 м / с [15]; молярна ізобарна теплоємність у протію Cp = 28,83 Дж / моль До менше, ніж у дейтерію Cp = 29,2 Дж / моль * К [23]; температура плавлення tпл = -259,19 С, теплота плавлення Hпл = 11,7 Дж / моль, температура кипіння tкип = -252,77 С і теплота кипіння Hкіп = 91,6 Дж / моль менше, ніж у дейтерію tпл = -254,42 С, Hпл = 19,7 Дж / моль, tкип = -249,9 С і Hкіп = 122,6 Дж / моль [14]; Поверхневий натяг при Т = 29К у протію = 0,498 мН / м менше, ніж у дейтерію = 1,612мН / м [33]. Великі відмінності спостерігаються у швидкості протікання хімічних реакцій різних ізотопів. Подібних аналогів відмінностей більше немає ні у одного з елементів, тому ізотопи водню і отримали індивідуальні назви. Ізотопи 4H і 5H отримані штучно і надзвичайно нестабільні.Молекули водню подібні з молекулами галогеном. Два атома в них пов'язані ковалентним зв'язком з відстанню 74,14 лм і енергією зв'язку 453,6 кДж / моль. Молекули водню володіють великою міцністю (при t = 5000 C ступінь дисоціації 0,95) і тому набагато більшою хімічною активністю володіє атомарний водень.Атомарний водень може довгий час не утворювати молекули у разі відсутності в ньому домішок. Так як для утворення молекули необхідно зіткнення трьох частинок дві з яких з'єднуватися, а третя понесе з собою надлишок енергії. Такими частками можуть служити домішки або навіть стінки посудини, в якому знаходитися атомарний водень. При зіткненні двох частинок утворилася молекула незабаром розпадається через надлишок енергії.Для молекул водню характерні дві модифікації: орто-водень o-H2 у якого обидва протона обертаються навколо свій осі в одному і тому ж напрямках, т. Е. Спини ядер паралельні, пара-водень p-H2 у якого протони обертаються в різних напрямках, т.е спини протилежні. Залежність відносини орто- і пара-водню залежить від домішок і від температури, чим менше температури тим більше пара-водню. Такі ж аллотропии характери для дейтерію і тритію, і, крім того, для азот.
<span>
</span>
Виявилося, що газ горить, вибухаючи, тому він був названий "горючим повітрям". У 1784 році Генрі Кавендіш, пропускаючи через суміш пального повітря і кисню електричну іскру, виявив, що в посудині з'явилася вода. Після низки точних дослідів, він переконався, що продуктом горіння була тільки вода, яка не мала запаху або смаку і при випаровуванні не залишала залишку. Таким чином, Генрі Кавендіш визначив хімічний склад води (H2O). До таких же висновків прийшов трохи пізніше французький хімік Антуан Лоран Лавуазьє (1743-1794). Латинське (Hydogenium) і російське назви походять від грецького hydro genes - породжує воду.
2. Становище в таблиці Менделєєва
Водень є першим хімічним елементом в періодичній системі. Його атом складається всього з двох елементарним частинок: протона, що є ядром і кайносімметрічного електрона обертового по s-електронної орбіталі, тому позитивний іон водню має найменші розміри (в 10000 разів менше) порівняно з атомом і володіє сильним поляризующим дією. Для атома водню застосовна квантова теорія Бора і рівняння Шредінгера для нього має точне рішення.
Водень займає особливе положення в періодичній системі і може бути віднесений, як до I, так і до VII головній підгрупі. Як лужний метал проявляє в з'єднаннях ступінь окислення +1, має яскраво виражені відновні властивості, для нього характерні реакції взаємного витіснення. Спектр водню подібний зі спектрами лужних металів. Але при цьому, як галоген може приєднувати електрон з утворенням іона водню H-, йому бракує одного електрона на зовнішньому енергетичному рівні, як і легкі галогени, він є газоподібним речовиною, його молекула складається з двох атомів, у з'єднаннях заміщається галогенами, потенціал іонізації порівняємо з представниками VII головної підгрупи (H-13,6 еВ, F- 17,4 еВ, а Li-5,6). Однак у атома водню відсутня ефект екранізування, на відміну від лужних металів, молекулярні орбіталі відрізняються від галогенів, тому можна розташувати водень цілком над другим періодом від літію до фтору.Спостерігаються відмінності між багатьма властивостями ізотопів водню, але внаслідок їх низького вмісту похибка вимірювань не велика. Найбільші відмінності спостерігається у термодинамічних величин, внаслідок відмінності частот коливань атомів викликаного відмінністю ізотопних мас. Швидкість звуку при t = 0 С в середовищі протію - 1284 м / с більше, ніж в середовищі дейтерію - 890 м / с [15]; молярна ізобарна теплоємність у протію Cp = 28,83 Дж / моль До менше, ніж у дейтерію Cp = 29,2 Дж / моль * К [23]; температура плавлення tпл = -259,19 С, теплота плавлення Hпл = 11,7 Дж / моль, температура кипіння tкип = -252,77 С і теплота кипіння Hкіп = 91,6 Дж / моль менше, ніж у дейтерію tпл = -254,42 С, Hпл = 19,7 Дж / моль, tкип = -249,9 С і Hкіп = 122,6 Дж / моль [14]; Поверхневий натяг при Т = 29К у протію = 0,498 мН / м менше, ніж у дейтерію = 1,612мН / м [33]. Великі відмінності спостерігаються у швидкості протікання хімічних реакцій різних ізотопів. Подібних аналогів відмінностей більше немає ні у одного з елементів, тому ізотопи водню і отримали індивідуальні назви. Ізотопи 4H і 5H отримані штучно і надзвичайно нестабільні.Молекули водню подібні з молекулами галогеном. Два атома в них пов'язані ковалентним зв'язком з відстанню 74,14 лм і енергією зв'язку 453,6 кДж / моль. Молекули водню володіють великою міцністю (при t = 5000 C ступінь дисоціації 0,95) і тому набагато більшою хімічною активністю володіє атомарний водень.Атомарний водень може довгий час не утворювати молекули у разі відсутності в ньому домішок. Так як для утворення молекули необхідно зіткнення трьох частинок дві з яких з'єднуватися, а третя понесе з собою надлишок енергії. Такими частками можуть служити домішки або навіть стінки посудини, в якому знаходитися атомарний водень. При зіткненні двох частинок утворилася молекула незабаром розпадається через надлишок енергії.Для молекул водню характерні дві модифікації: орто-водень o-H2 у якого обидва протона обертаються навколо свій осі в одному і тому ж напрямках, т. Е. Спини ядер паралельні, пара-водень p-H2 у якого протони обертаються в різних напрямках, т.е спини протилежні. Залежність відносини орто- і пара-водню залежить від домішок і від температури, чим менше температури тим більше пара-водню. Такі ж аллотропии характери для дейтерію і тритію, і, крім того, для азот.
<span>
</span>
0
0