ДА, температурный коэффициент скорости реакции тем выше, чем выше энергия активации.
Скорость реакции пропорциональна частоте столкновений молекул, с коэффициентом - экспонента с показателем минус Ea/RT (не могу здесь написать формулу в тексте - см. в википедии "Уравнение Аррениуса", там она есть).
Частота столкновений растёт как корень из (абсолютной) температуры, т.е. медленнее, чем по экспоненте.
В пределе, если энергия активации равна нулю, т.е. каждое столкновение молекул приводит к реакции - скорость реакции будет расти только за счёт роста числа столкновений, очень медленно.
Средняя кинетическая энергия молекул линейно пропорциональна температуре, так что доля молекул, имеющих энергию выше энергии активации, с температурой растёт. В целом получается, что в некотором диапазоне температур
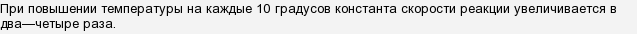
Эти "2-4 раза" и есть температурный коэффициент скорости реакции. Эта закономерность называется правилом Вант-Гоффа. Оно эмпирическое и приблизительное.

См. в википедии "энергия активации", "Уравнение Аррениуса".